西湖大学细胞药物与递送技术实验室长期专注于细胞治疗与递送技术的原创创新与临床转化。团队率先开发了全球首创的免疫红细胞药物,通过将抗体、小分子或核酸药物偶联至红细胞,充分利用其在外周免疫器官的天然富集与免疫互作特性,实现精准的抗肿瘤和免疫调控。基于这一从0到1的原创突破,团队已将红细胞药物推进至临床试验,并在全球首次实现后线实体瘤患者的完全缓解,开辟了免疫耐药与泛实体瘤治疗的新路径。同时,团队还推动红细胞产品在痛风、心血管疾病及罕见病中的转化应用,为多类重大疾病提供全新解决方案。此外,为突破基因与核酸药物递送的瓶颈,团队提出并构建了基于哺乳动物内源蛋白凝聚体(coacervate)的第四代递送系统。该体系解决了传统递送手段在效率、安全性和产业化上的多重限制,具有高效、低毒和标准化生产的优势,能够稳定递送 mRNA、DNA 等核酸药物。目前已发展为系列化产品,并在全球科研与产业界广泛应用。
红细胞体外工程化平台
利用工程化的红细胞治疗癌症、自身免疫病、罕见病、代谢性疾病、病毒感染性疾病等多种疾病。宫颈癌是危害妇女健康的主要恶性肿瘤之一,晚期及复发性宫颈癌的治疗在妇科肿瘤界仍是一个巨大的挑战。治疗型HPV疫苗相对于传统治疗方式虽已表现出更好的效果,但是,如何增强新生抗原治疗性疫苗的免疫应答效率仍是亟待解决的重要问题。基于红细胞的新型药物载体系统携带肿瘤特异性抗原融合蛋白可被效应T细胞受体识别,被激活的T细胞可识别并杀伤肿瘤细胞。痛风是最常见的炎症关节疾病,已成为仅次于糖尿病的第二大代谢疾病,目前临床上治疗痛风的药物仍比较匮乏。利用红细胞体外工程化平台将尿酸氧化酶偶联至天然红细胞上,尿酸氧化酶随着红细胞长期在循环系统中清除过饱和尿酸盐,显著延长其体内药效,增强治疗效果。溶栓药物一直以来都存在半衰期短、出血、毒副作用强等诸多的问题。利用工程化红细胞搭载抗血栓药物可有效延长药物半衰期,极大降低药物使用剂量,实现良好的抗血栓疗效。
通过多种方法对分化早期的造血细胞进行改造,成功实现了体外培养条件下的大量扩增。通过基因工程编辑手段,体外生成永生化红细胞并进一步通过优化不同的分化培养方案将其定向分化成为成熟红细胞。这一“体外造血”技术对解决全球血液供应不足及创伤或外科手术大量输血等临床用血需求具有重大意义。同时,对外周血干细胞在红系分化过程中的脱核机制,红细胞衰老或受损后的清除、降解机制等基础科学问题进行探索性研究,可对临床疾病的治疗提供指导与帮助。
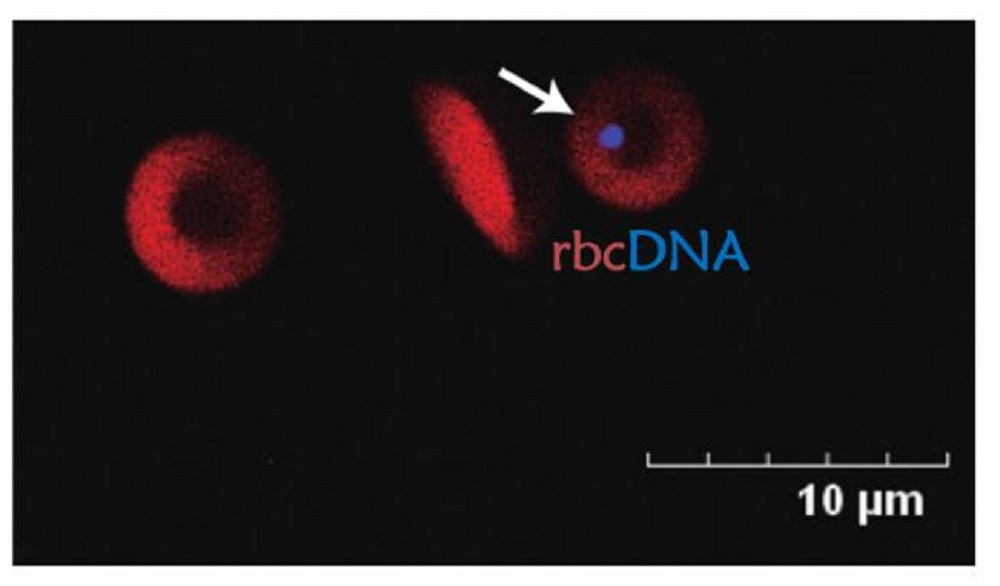
利用红细胞内残留 DNA(rbcDNA)进行疾病筛查
在哺乳动物中,成熟红细胞没有细胞核。但早在一个多世纪前,含有DNA的微核就在外周血红细胞中被观察到。然而,红细胞中微核DNA信息与疾病发生发展的关系,目前尚不清楚。本实验室首次建立了一套高效稳定的红细胞DNA(rbcDNA)检测分析系统,分析并研究癌症患者和健康人群rbcDNA特征及其形成机制。结果提示,rbcDNA可以作为一种新型生物标志物在癌症等疾病的早期筛查以及个体健康风险监测中具有广阔的应用潜力和前景。见微知癌– 基于微核DNA的新型检测产品我们利用独家的样本处理和新型DNA标志物富集手段,对大量临床数据进行分析整合后,结合专有的机器学习及 AI 算法,实现了对至少 15 种高发癌症的精准筛查。仅需一管外周血,无需特殊准备,便捷无创,方便嵌入各类检测服务流程中,可大幅提高受试者的依从性。2 ml外周血中细胞内的taMN-DNA 就可以用于多种癌症筛查累计超过2万例临床样本的检测和多项临床研究,rbcDNA多癌联检技术的整体灵敏度达到88.4%,特异度95.7%。

© COPYRIGHT 2023. BIAN LAB AT WESTLAKE UNIVERSITY 浙ICP备18025489号